Suyun özellikleri: izotoplar ve moleküler yapı.
Su 1'in özellikleri: genel
Su 2'nin özellikleri: fiziksel ve kimyasal özellikler
Suyun izotopik bileşimi
Su, çekirdekteki protonlarla ilişkili nötron sayısında birbirinden farklılık gösteren çeşitli oksijen ve hidrojen izotop kombinasyonlarının bir karışımıdır.
1H,2 H (döteryum)3H (Trityum)
16O, 17O,18O.
izotop oranları:
Hidrojen için:
2H/1H = 1 / 6900
3H/1H = 1 / 10 18
Trityum kararsız bir eleman zamanı (yarılanma ömrü) 12,5 yıldır.
Oksijen için:
18O/16O = 1 / 500
17O/16O = 1 / 2500
aşağıdaki gibi 4 ana moleküler türler ve bunların frekansı:
1H216O = 99,7%
1H2 18 O = 0,2%
1H217O = 0,04%
1HD16O = 0,03%
D216O = çok düşük
Farklı izotoplar, özellikle bunların yoğunluğu moleküller fiziksel özelliklerindeki farklılıklar, indükleyememekte, ancak kimyasal özellikleri aynı kalır.
Ağır su D2O doğal haliyle var ama çok
düşük. Kayda değer bir miktara sahip olmak için, izotop ayırma tekniklerinde ustalaşmak gerekir: Bu, atom silahını hazırlamak için son dünya savaşındaki temel zorluklardan biriydi.
Suyun kimyasal bileşenlerinin izotopik bileşimi, sıcaklık gibi termodinamik parametrelerin tahmininde kullanılır;
rapor 18 O/16O Kutup başlıklarından gelen buz ve fosil yeraltı sularından gelen su, geçmişin iklimi hakkında bilgi sağlar.
Okyanus suyunun buharlaşması, izotopik fraksiyonlama ile gerçekleşir: Oksijenin hafif izotopu, ağır izotop tercihan buharlaşır. Okyanuslar, ağır izotoplarda bulutlardan ve yağışlardan gelen sudan daha zengindir.
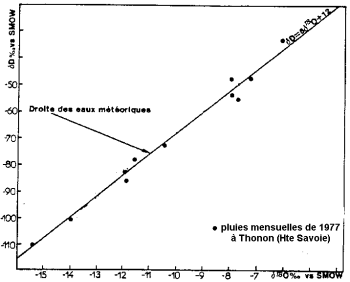
Çökeltinin kararlı izotop içeriği (Blavoux ve Letolle, 1995'ten sonra).
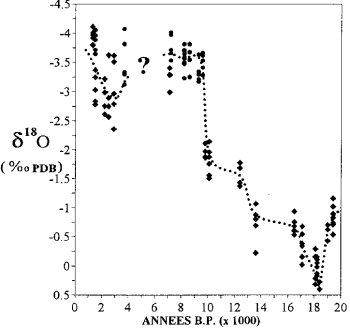
Mayotte'deki mercanlarda oksijen izotop içeriğindeki varyasyon (Casanova ve diğerleri, 1994'ten sonra).
molekülün yapısı
Hidrojen ve oksijen atomları elektronlarını bir araya getirerek neon gibi tam bir katman oluşturur. Aslında oksijen atomu, elektronik kabuğunu tamamlamak için 2 elektrondan yoksundur, onu sağlayan 2 hidrojen atomudur. Oluşan H2O molekülü stabildir.
Oksijen: 8 8 proton + nötron
Hidrojen: 2 (2 * (1 1 nötron proton +))
Toplam: Protonlar 10 10 elektron yükleri dengeleme.
Hidrojen çekirdeği, karakteristik bir "Mickey kafası" (hidrojen kulaklardır) oluşturmak için oksijenin bir tarafına sahiptir.
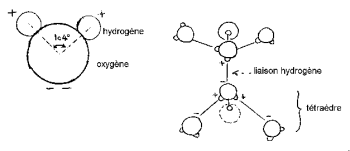
HOH açısı 104,474 ° 'dir (dört yüzlü geometrinin özelliği). Oksijen ve hidrojen atomu arasındaki mesafe buhar içinde 1 A ° 'ye (0,95718 A °) yakındır. Molekülün etkili çapı 2,82 A ° mertebesindedir.
Bu küçük molekülde elektrik yükleri eşit olmayan bir şekilde dağılmıştır. Elektronlar, oksijen atomuna hidrojen atomundan daha güçlü bir şekilde çekilir. Hidrojen çekirdeğinin yakınında 2 pozitif yük merkezi ve oksijen çekirdeğinin yakınında 2 negatif yük merkezi vardır. Su molekülünün doğrusal olmayan geometrisi ile birleşen yük dağılımındaki bu dengesizlik, kendisini güçlü bir elektrik dipol momentinin varlığında gösterir. Su molekülü kutupsaldır; diğer polar moleküllerle bağlanabilen bir elektrik dipolü gibi davranır. Aslında, su molekülleri, bir kristalin kurucu iyonları arasına, zıt elektrik yükünün bir kısmını onlara doğru yönlendirerek yerleştirilebilir. Kristalin iyonların çekiciliği büyük ölçüde zayıflar ve kristalin kohezyonu azalır, bu da çözünmesini kolaylaştırır. Su molekülünün kutupsal özellikleri, mikrodalga ısıtma tekniğini açıklar. Gerçekte, polarize bir molekül kendisini bir elektrik alanına göre yönlendirir; bu değişirse, molekül yönelimindeki değişikliği takip eder. Moleküllerin hareketleri belirli bir frekanstan, su için birkaç GHz'den sürtünmeyle ısı üretir. Ev tipi fırınlar tipik olarak UHF olan 2,45 GHz frekansında çalışır.
Molekülün 3 çekirdeği sabit değildir, birbirlerine göre hareket ederler, molekül titreşir ve bükülür. Sıvı suda moleküller ilişki kurma eğilimindedir: Mickey'nin kafaları kulağı hidrojen bağıyla çeneye bağlar. Aslında, oksijenin 8 periferik elektronundan sadece 4'ü hidrojen atomlarıyla kovalent bağlarda rol oynar. Kalan 4 elektron, serbest elektron çiftleri adı verilen 2 çift halinde gruplandırılır. Bu negatif elektrik yüklü çiftlerin her biri, yakındaki bir su molekülünden pozitif yüklü bir hidrojen atomu ile elektrostatik bir bağ oluşturabilir. Oda sıcaklığında stabil olan hidrojen bağı yine de kovalent bağa kıyasla kırılgandır. Su molekülünde, 2 kovalent bağın ve 2 serbest elektronik çiftin yönüyle oluşturulan geometri, merkezi oksijen çekirdekleri tarafından işgal edilen bir tetrahedronunkine yakındır.
Bununla birlikte, su molekülünün büyük yapısı hala tam olarak bilinmemektedir. X-ışını ve nötron kırınım spektrumları 2 ana değer sağlar: 1 A ° 'ye karşılık gelen bir sinyal, hidrojen ve oksijen çekirdekleri arasındaki mesafe ve sıcaklığa göre değişen 2,84 ila 4 A ° arasındaki bir değer ve 2 oksijen çekirdeği arasındaki mesafeye karşılık gelir. X ışını difraktometrisi, belirli bir molekülden R mesafesinde bulunan birim sıvı hacmi başına ortalama molekül sayısını bilmeyi de mümkün kılar. Bir su molekülünün ortalama 4,4 komşusu vardır, bu da dört yüzlü bir ağa işaret eder. Hidrojen bağlarıyla bağlanan moleküllere ek olarak, başka bağlanmamış moleküller de vardır; bu, komşu moleküllerin sayısının neden 4'ten biraz fazla olduğunu ve tam olarak katı bir dört yüzlü kristalize durum için gerekli olan 4 olmadığını açıklayabilir. Hidrojen bağlarıyla bağlanan moleküllerin kristal kafesi, bağlanmamış moleküllerin barındırılacağı boşluklar oluşturacaktır. Diğer bir hipotez, hidrojen bağlarının bozulmasına dayanmaktadır. İkincisi, orijinal olarak doğrusal, yani O - HO atomları hizalandığında değişen derecelerde bükülebilir ve yakın komşulardan daha uzak moleküllerin merkezi moleküle yaklaşmasına izin verebilir.
Teorik modeller son zamanlarda güçlü bilgisayarlar kullanılarak geliştirildi. Su moleküllerinin yaklaşık% 80'inin 3 veya 4 hidrojen bağına dahil olduğunu gösterirler; diğer yandan, bağlanmamış moleküllerin varlığını dışlarlar. Bilgisayar modellemesi, su soğudukça, molekül ağlarının buzdakine benzer şekilde altıgenlere benzediğini öne sürüyor.
Katı hal, daha katı kristalli bir düzenlemeye karşılık gelir. Normal basınçta buzun altıgen bir yapısı vardır. Düşük sıcaklıkta (-80 ° C'nin altında) kübik bir yapı alabilir. Elektrik yükleri kristal kafeste hareket edebilir ve iyonik tipte kristal kusurları oluşturabilir: hidratlı proton H3O + ve hidroksil iyonu OH-. Buzun kristal kafesi, mümkün olan en kompakt molekül yığınına karşılık gelmiyor. Füzyonda, kusurlar çöker çünkü hidrojen bağları kırılır ve moleküller birbirine yaklaşır: yoğunluk 4 ° C'de maksimuma çıkar. Daha sonra sıvı suda sıcaklık artışı molekülleri birbirinden ayırır ve yoğunluk azalır.
Detaylar, referanslar ve kaynakça:
Blavoux B. ve Letolle R. (1995) - İzotopik tekniklerin yeraltı suyu bilgisine katkısı. Geochronics, 54, s. 12-15.
Caro P. (1990) - Suyun fiziksel ve kimyasal özellikleri. Büyük su kitabı, La Villette, s. 183-194.
Eagland D. (1990) - Suyun yapısı. Araştırma, 221, s. 548-552.
Maidment DR (1992) - Hidrojeoloji El Kitabı. Mc Graw Hill.
Casanova J., Colonna M. ve Djerroud K. (1994) - Jeoprospektif - paleoklimatoloji. Rap. bilim. BRGM, s. 76-79.

